С большой радостью сообщаю, что РЗН выдал регистрационное удостоверение № РЗН 2024/21946 от 31.01.2024 г. на набор ИГРА-ТБ! Огромное спасибо вам за профессионализм, ...
Что такое валидация и валидация процесса стерилизации?
Валидация - документированная процедура получения, регистрации и интерпретации результатов, необходимая для демонстрации того, что на выходе процесса будет воспроизводимо получаться продукция, соответствующая заранее определённым техническим требованиям (ISO/TS 11139:2006)
Валидация процесса стерилизации - документированное подтверждение того, что процесс стерилизации, проводимый в пределах установленных параметров, может осуществляться эффективно, с воспроизводимыми результатами и приводит к получению стерильного продукта.
Зачем нужна валидация?
Валидация процесса радиационной стерилизации необходима в следующих случаях:
- В рамках подготовки к регистрации медицинского изделия в Росздравнадзоре;
- В рамках выполнения требований стандарта ISO 13485 производителями стерильных медицинских изделий имеющих сертифицированную систему менеджмента качества - процессы стерилизации являются одними из наиболее критических операций, по этому их необходимо валидировать (прямое требование GMP);
- Для демонстрации надзорным органам того, что процесс стерилизации неизменно выдаёт стерильный (т.е. безопасный) продукт.
Нормативные документы:
- ISO 13485:2016 «Изделия медицинские. Системы менеджмента качества. Требования для целей регулирования»;
- ГОСТ ISO 11137-1-2011 (ISO 11137-1:2006) «Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий»;
- ГОСТ Р 56431-2015 (GNTF/SG3/N99-10:2004) «Система менеджмента качества. Изделия медицинские. Руководство по валидации процессов».
Что происходит при неправильно выполненной валидации?
Появление нестерильных медицинских изделий в стационарах
- Основной риск нарушения качества процесса стерилизации – появление нестерильных медицинских изделий, приводящих к развитию внутри-больничных инфекций при использовании. Внутри-больничные инфекции являются колоссальной проблемой для системы здравоохранения;
- Прямой контроль стерильности затруднен так как для подтверждения УС 10-6 необходимо протестировать на стерильность 1 млн изделий. Решение периодическое выполнение процедур валидации.
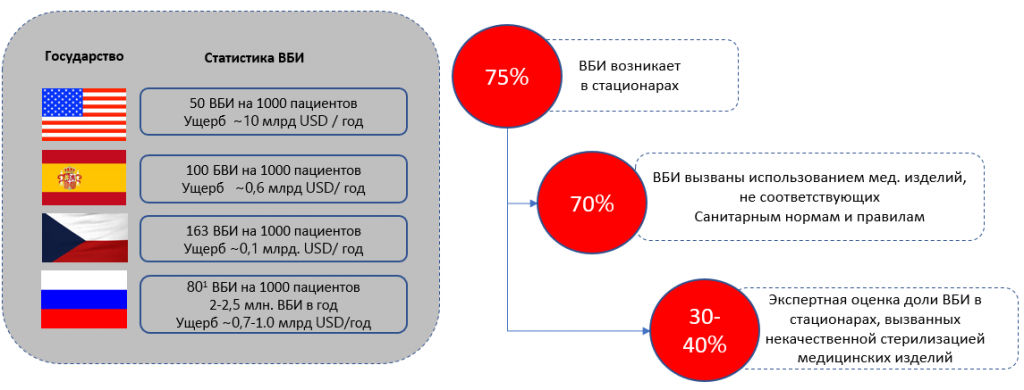
Приведена неофициальная статистика. Официально в РФ ~1 ВБИ на 1000 пациентов. Проблема некорректной статистики по ВБИ признана на уровне Минздрава и Роспотребнадзора. Приведена оценка реального уровня ВБИ на основании расчетов НИИ Эпидемиологии Роспотребнадзора.
Негативное влияние на продукцию

Заявка на консультацию
В рамках форума AMTEXPO Директор по развитию ГК «АКЦЕНТР» Кузнецов Антон Александрович принял участие в панельной дискуссии «Полимерные материалы - импортозамещение и перспективы развития» c докладом о применении электронно-лучевой обработки полимерных материалов с целью улучшения физико-механических и других свойств материалов для различных отраслевых применений.
В рамках международной научно-практической конференции «Косметическая индустрия: взгляд в будущее» Директор по развитию ГК «АКЦЕНТР» Кузнецов Антон Александрович принял участие с докладом на тему «Решение проблем микробиологической безопасности парфюмерно-косметической продукции» ...

